En los tiempos del internet y las redes sociales, pareciera que los rumores y opiniones corren más rápido que las ondas sísmicas. El problema es que corren tan rápido que la mayor parte del tiempo se adelantan a un análisis fundamentado de su veracidad, como ha ocurrido con esa peligrosa afirmación de que el alcohol sería un analgésico más efectivo que el paracetamol.
En forma similar a ese mito difundido por los medios de comunicación, hace un tiempo se puso en circulación en los algunos medios locales e internacionales referencias a un artículo que supuestamente confirma la toxicidad del timerosal.
El timerosal es un compuesto que se incluye en algunas vacunas como preservante, evitando su contaminación. Es un compuesto a base de mercurio etílico (etilmercurio... sí, como este medio) y ha dado bastante de qué hablar debido a las alarmas desatadas por grupos antivacunas que afirman hasta el día de hoy que se vincularía al autismo (nunca nos olvidamos de ti, Andrew Wakefield y tu paper retractado por inventar datos) o que, como se trata de un derivado de un metal pesado como el mercurio, sería un elemento tóxico y muy peligroso. Con la llegada de Donald Trump a la Casa Blanca, el miedo a las vacunas ha cobrado más fuerza. Esto pese a que ambas hipótesis han sido descartadas una y otra vez (1) (2).
Todo esto pareció cambiar el 10 de mayo de 2016, cuando se publicó el siguiente artículo en la revista científica Reviews of Environmental Contamination and Toxicology : «Alkyl Mercury-Induced Toxicity: Multiple Mechanisms of Action» (3), de John R. Risher y Pamela Tucker. Tal como asegura su título, el artículo afirma, a través de la revisión de numerosas investigaciones y artículos previamente publicados, que tanto el metilmercurio como el etilmercurio serían componentes tóxicos para el ser humano.
Este artículo ha recibido más prensa en los últimos meses particularmente porque ha sido difundido por Robert F. Kennedy, un conocido activista ambiental y escéptico de las vacunas, y por el actor Robert «you talking to me» de Niro (otro famoso opositor a las vacunas). Estos dos personajes han usado el artículo como argumento para justificar una singular apuesta: prometen pagar la suma de USD 100.000 a quien logre demostrar que «el timerosal es seguro en las cantidades contenidas en vacunas que actualmente son administradas a niños estadounidenses y mujeres embarazadas».
Una de las cosas que destacan en los sitios que han difundido este artículo es que los autores de esta revisión son «científicos del CDC» (Centros para el Control y la Prevención de Enfermedades, una importante organización estadounidense) o que es una «confirmación» de lo tóxico que es el timerosal. Incluso en Chile, un honorable senador, una diputada y el mismo presidente del Colegio Médico difundieron esta idea (?). Algunos llegaron a hablar de «vacunas limpias», dando a entender que para ser «limpias» debían estar libres de timerosal.
El senador Girardi presenta tres aseveraciones en este tuit. Primero, su apoyo a las vacunas; segundo, sus aprensiones al timerosal por considerar que contiene mercurio (nótese que para el senador esto significaría que el «etilmercurio» y el «mercurio» son equivalentes); tercero, la afirmación de que el timerosal es tóxico. Es cierto que no podemos exigirle mucha profundidad a un texto de 140 caracteres, pero sí resulta importante tener sus afirmaciones bien fundamentadas antes de provocar dudas en la población sobre algo tan importante para la salud pública como la vacunación.
Hay un viejo adagio que dice «a afirmaciones extraordinarias, pruebas extraordinarias». La comunidad científica es, en efecto, bien tozuda y no aceptará con facilidad que se ha equivocado si tiene toneladas de evidencia que apoyan su punto. Sin embargo, en Etilmercurio hemos querido mantener la mente abierta y darle a este nuevo artículo el beneficio de la duda (arriesgándonos con ello a tener que discutir si mantenemos nuestro nombre). Después de todo, si hay tantas personas citándolo y hasta apostando dinero por él, algo debe haber descubierto, ¿no?
Así es que, sin más preámbulos, vamos a desmenuzar el artículo de Risher y Tucker.
Escoger a dedo unas cerezas que resultan ser melones
En primer lugar hay que hacer notar que el artículo no es una investigación original. Es decir, Risher y Tucker no anduvieron inyectando timerosal en personas y estudiando sus efectos o algo por el estilo.
Tampoco es un metaanálisis ni una revisión sistemática, pues el artículo ni siquiera contempla una sección de material y métodos donde se aclare la estrategia de búsqueda, elemento clave para poder realizar este tipo de artículos. ¿Y por qué habría que aclarar una estrategia de búsqueda? Pues para evitar sesgos: si escojo con pinzas los artículos que voy a revisar, puedo darme el lujo de quedarme sólo con los que apoyan mi punto de vista e ignorar los que lo contradicen. A esto se le conoce como falacia de evidencia incompleta, llamada en inglés con el nombre muy gráfico de cherry picking (algo así como «elegir las cerezas»).
Lo que los autores realizaron fue una revisión de literatura sobre un tema, sin aclarar a sus lectores la estrategia utilizada (bases de datos donde se buscó la información, límites temporales, idiomas consultados, si filtraron la literatura gris, entre otras). Por lo tanto, en estricto rigor, no contiene información nueva: la información que presenta proviene de una recopilación de trabajos ya realizados y que ha sido usada para darle soporte a la hipótesis de los autores. En este caso, que los mecanismos de acción tanto del etilmercurio como del metilmercurio son similares. Lo que finalmente es interpretado en este artículo como que ambos compuestos serían igualmente tóxicos.
Aquí se presenta nuestra primera duda: si no se presenta información nueva, ¿cómo es que la comunidad científica no vio antes esto? ¿Cómo fuimos tan irresponsables para promover el uso de un compuesto y asegurar que era inocuo si la evidencia apuntaba hacia otro lado? Es por ello que lo primero que hicimos fue revisar la bibliografía citada para ver desde hace cuánto tiempo se sabía esto y quién lo averiguó.
Pero lo que descubrimos nos dejó con la boca abierta: las investigaciones citadas no apoyan la tesis difundida en los medios locales de comunicación. Aun más: muchas de ellas incluso las refutan.
Lo repetimos para que quede bien claro: a lo largo de todo el artículo usted se encontrará con referencias bibliográficas que refutan o simplemente no confirman la hipótesis de los autores. Escrito de otro modo: los autores buscaron artículos científicos, los leyeron, los seleccionaron y los anotaron como referencia de su propio artículo, a pesar de que no dicen nada de lo que ellos afirman (!!!).
Más grave aún: en ciertas secciones, los autores citan estudios que supuestamente confirman su hipótesis, pero estos estudios ni siquiera mencionan al compuesto etilmercurio.
«Los compuestos de alquilmercurio metilmercurio (MeHg) y etilmercurio (EtHg) han mostrado ser tóxicos tanto para humanos como para otros animales (Driscoll et al. 2013)».
El estudio de Driscoll y colaboradores que los autores utilizan para justificar su hipótesis al inicio del prefacio no menciona en ninguna parte al compuesto etilmercurio: sólo habla del metilmercurio. No tiene por qué creernos: puede revisar por su cuenta el artículo si gusta (10).
Bueno, puede ser un pequeño error, ¿no? Quizás a los autores se les perdió la cita correcta, pero el resto está bien...
Pero no. Esto no queda sólo ahí: en su gran mayoría, los artículos incorporados en la revisión sólo hacen mención a la toxicidad del mercurio (Hg) y otros alquilicos de mercurio como el metilmercurio, un compuesto muy diferente al etilmercurio.
Es más, a pesar de que la discusión ha sido en torno el etilmercurio o al timerosal, sólo el 29% de las referencias usadas los mencionan o tratan sobre ellos.
Sopa de mariscos adobada con metilmercurio
Recordemos un poco de química: el mercurio (Hg) es un metal pesado que se encuentra de forma natural en el medio ambiente. En su forma pura (mercurio elemental) y a temperatura ambiente, es un metal líquido que se usa en termómetros y en píldoras de «inmortalidad» como las que le quitaron la vida al emperador Qin Shihuang.
Las formas químicas que comúnmente se encuentran en la naturaleza son el mercurio inorgánico y el mercurio orgánico (metilmercurio y etilmercurio). Muchos fenómenos naturales y actividades humanas pueden liberar mercurio al medio ambiente, que se deposita en el aire, agua y tierra. Tanto el mercurio elemental como las sales inorgánicas son transformadas en mercurio orgánico por procesos biológicos. De esta forma, puede acumularse en peces y organismos marinos que luego consumimos (11) (esta es la fuente principal de metilmercurio en nuestros cuerpos).
Por otra parte, el timerosal es un componente organomercurial que contiene 50% de mercurio y se metaboliza a etilmercurio y tiosalicilato. El timerosal ha sido utilizado como preservante en la producción de vacunas desde 1930, fundamentalmente, para evitar la contaminación bacteriana y fúngica durante la elaboración de las vacunas o en los frascos de vacunas envasadas en multidosis (9).
Volvamos al artículo de Risher y Tucker: su problema no es sólo que hable de manzanas citando artículos que tratan sobre peras. La forma en que presenta sus argumentos se ha prestado para todo tipo de malinterpretaciones por parte de grupos antivacuna y medios de comunicación esotéricos. Un ejemplo claro de esto es la revisión de un estudio sobre la toxicidad in vivo del etilmercurio.
Para lo siguiente, hay que tener claro dos cosas: un estudio in vitro es básicamente un experimento realizado en un ambiente artificial, en condiciones controladas y fuera de un organismo vivo (por ejemplo en una placa de cultivo). Mientra que los estudios in vivo son aquellos realizados en organismos vivos (animal o planta).
En general, el artículo de Risher y Tucker cita estudios que evalúan mecanismos de acción in vitro. Pero también cita un estudio con el que buscan validar la toxicidad in vivo del etilmercurio. En ese estudio, se administra a ratas de laboratorio una dosis de etilmercurio 2 mil 500 veces más alta que la dosis humana normal.
«(. . .) Por lo tanto, la dosis administrada a las ratas fue aproximadamente 2.500 veces mayor que la dosis administrada a seres humanos. (. . .) Sumado a lo anterior, las dosis de mercurio desproporcionadamente altas limitan en sí mismas la relevancia de los hallazgos de Ida-Eto a un posible mecanismo, y no necesariamente a la toxicidad del mercurio presente en el timerosal de las vacunas».
Debemos insistir que lo que hace este artículo es mencionar y describir los mecanismos de acción de ambos compuestos (metilmercurio y etilmercurio), que han mostrado ser similares en varios aspectos. Llegado este punto, una buena comprensión lectora es esencial: muchos escépticos de la vacunación insisten en que el artículo de Risher y Tucker afirma que el metilmercurio y el etilmercurio son igual de tóxicos.
Pues no es así.
Los mismos autores concluyen que la diferencia de toxicidad entre el metilmercurio y el etilmercurio no es su mecanismo de acción, sino cómo se metaboliza en el cuerpo y cómo se eliminan ambos compuestos. Estos procesos son muy distintos dependiendo de si hablamos de etilmercurio o metilmercurio, que es precisamente la posición que han mantenido la CDC y OMS durante todo este tiempo. Es decir, nada nuevo al respecto.
«This paper represents a summary of some of the studies regarding these mechanisms of action in order to facilitate the understanding of the many varied effects of alkylmercurials in the human body. The similarities in mechanisms of toxicity for MeHg and EtHg are presented and compared. The difference in manifested toxicity of MeHg and EtHg are likely the result of the differences in exposure, metabolism, and elimination from the body, rather than differences in mechanisms of action between the two.»
Pero, ¿cuál es la diferencia entre «mecanismo de acción» y «toxicidad»?
¿Para quién? Paracelso.
Si intentamos definir de forma sencilla el concepto de toxicidad, podemos decir que es la capacidad de una sustancia de producir efectos adversos a un organismo cuando entra en contacto con él. Sin embargo, aquí es donde entra en juego nuestro amigo Paracelso con su célebre frase «la dosis hace el veneno»: casi cualquier sustancia puede ser considerada tóxica si se administra en dosis mayores a las recomendadas.
Por otra parte, están los mecanismos de acción: en general, este concepto se usa en farmacología para definir la acción bioquímica específica a través de la cual una sustancia produce su efecto. Si hablamos, por ejemplo, de un fármaco, nos referimos al efecto farmacológico. Si estamos en el terreno de la toxicología, nos referimos al efecto adverso. La diferencia entre ambos conceptos radica sobre todo en determinar en qué concentración una sustancia produce un efecto adverso (tóxico) y cuál es ese efecto adverso o acción bioquímica específica (mecanismo de acción).
Para poder estudiar la toxicidad per se, en general se hacen experimentos que someten de forma directa los compuestos a los tejidos o células objetivo in vitro. En este caso, se aplicaría directamente un compuesto tipo alquílico de mercurio (metilmercurio o etilmercurio) a células objetivo en condiciones de laboratorio, en una placa petri, manipulando las concentraciones, etc.
En concentraciones elevadas, efectivamente algunos estudios (como el de Ida-Eto et al. 2011, citado previamente) muestran que el etilmercurio puede llegar a ser tóxico (tan tóxico a elevadas concentraciones como la sal, el agua o el té verde). Pero acá seremos insistentes: esto NO significa que la exposición de un organismo al compuesto va a tener la misma toxicidad.
Primero, nunca nadie va a usar tales concentraciones de etilmercurio ni en vacunas, ni en medicamentos tópicos nasales y oftálmicos, ni en tintas para tatuajes ni en nada nada que contenga timerosal y sea administrado en humanos. De la misma forma, nadie recomienda tomar 5.000 litros de agua diarias o comer 25 kilos de sal. Y es más: no da lo mismo beber dos litros diarios de agua de la llave o de agua de mar (por favor, ni se le ocurra beber la última).
Segundo, los organismos son un poco más complejos que eso y, en general, han desarrollado mecanismos de defensa ante las toxinas. En este caso, y como se ha repetido hasta el cansancio, el etilmercurioⓇ tiende a metabolizarse o removerse bastante rápido (tiene una vida media de 7 días; luego es eliminado a través de las heces). Por ello, resulta muy poco probable que llegue a entrar en contacto directo con los tejidos que han mostrado ser sensibles a dosis elevadas (y, por lo tanto, a que manifiesten los efectos adversos descritos en el artículo).
Tal y como esta revisión menciona en repetida ocasiones:
«El timerosal se metaboliza rápidamente in vivo, debido a sus reacciones con los tioles proteicos y no proteicos (Wu et al. 2008); por ende, es altamente probable que los efectos del timerosal reportados en numerosos artículos se deba a la exposición al metabolito etilmercurio».
«Las diferencias en toxicidad entre el MeHg y el EtHg probablemente se deben al rápido metabolismo y eliminación del EtHg en comparación al MeHg y a la cantidad de mercurio a la cual es más probable que ocurra una exposición significativa (por ejemplo, exposición al MeHg debido al frecuente consumo de pescados v/s la pequeña y ampliamente espaciada exposición al EtHg a través del timerosal en vacunas con viales multidosis.».
Seremos bien majaderos en este punto: acá no se está confirmando la toxicidad del timerosal. Lo que hicieron Risher y Tucker fue revisar los mecanismos de acción de ambos compuestos y, dado que son similares, destacar a qué se deben las diferencias en toxicidad.
Vacunas «limpias»
La publicación y difusión del artículo de Risher y Tucker no se hace en un ambiente neutro, sino en uno cargado de apasionadas discusiones sobre los supuestos «cuestionamientos» a las políticas de vacunación. Y, en este panorama, ha surgido la idea de que existirían vacunas «limpias» (dando a entender que las vacunas que se usan actualmente son «sucias», que podrían hacer daño).
Como explicamos anteriormente, se ha demostrado una y otra vez que las vacunas que se usan habitualmente en los planes de vacunación son seguras y, además, son fundamentales para mantener a raya un sinnúmero de enfermedades peligrosas (polio, sarampión, rubéola, difteria, influenza, VPH, entre otras). Por ello, no resulta raro que surja un argumento de consenso: si hay gente que está a favor de la vacunación pero cuestiona las vacunas con timerosal por creerlas «sucias», ¿por qué no mejor usamos vacunas sin timerosal y listo, todo el mundo feliz?
No es tan simple.
El timerosal es un componente que, como decíamos antes, se usa para preservar vacunas desde la década de 1930. Es, por lo tanto, un componente sin patente industrial vigente, lo que lo hace muchísimo más barato que los conservantes alternativos surgidos en la última década. La misma Organización Mundial de la Salud explica que eliminar totalmente el timerosal en las vacunas «exigiría que se utilizaran otros conservantes o que sólo se utilizaran vacunas monodosis sin conservantes. Las presentaciones alternativas (con otros conservantes o sin conservantes) supondrían grandes costos en los procesos de desarrollo y registro, reduciendo así la oferta de vacunas asequibles» (5). Estos costos se ven reflejados, por ejemplo, en cambios a la cadena de frío, de almacenamiento y residuos, entre otros (12). Además, habría discontinuidad en los programas de inmunización, ya que estas vacunas alternativas no están disponibles en cantidades suficientes (12).
A una conclusión similar llegó el Oficio del Presidente de la República de Chile el 4 de marzo de 2014, cuando se vetó el proyecto de ley aprobado por el Congreso Nacional que eliminaba las vacunas multidosis con timerosal o compuestos organomercúricos. Uno de sus argumentos para vetar esta ley es que el «Comité Consultivo Mundial sobre Seguridad de las Vacunas ha examinado los datos científicos relativos al uso del timerosal como conservante en vacunas durante más de 10 años y ha llegado repetidamente a la misma conclusión: la evidencia disponible apoya fuertemente la seguridad del timerosal como preservante para vacunas inactivadas y no se necesitan estudios adicionales en relación a la seguridad del timerosal en vacunas» (12). Esta conclusión es apoyada por el Grupo Técnico Asesor sobre Enfermedades Prevenibles por Vacunación de la Organización Panamericana de la Salud, el Instituto de Medicina de Estados Unidos de América, la Academia Americana de Pediatría, el Comité del Reino Unido sobre seguridad de la Medicina y la Agencia Europea para la Evaluación de Medicamentos (12).
Es más: reemplazar el timerosal por preservantes alternativos «implicaría una nueva autorización o registro sanitario de cada vacuna reformulada en cada país donde se pretenda su uso, proceso que puede tomar años completar al incluir evaluaciones de calidad e información clínica. Los preservantes alternativos disponibles actualmente interactúan con antígenos y excipientes presentes en las vacunas de manera impredecible y no se visualizan otros preservantes consensuados para un futuro cercano» (12).
Entonces, si las vacunas que usan timerosal (un componente libre de patentes industriales y, por lo tanto, más barato de producir y manejar que uno alternativo o con patente vigente) han demostrado ser seguras una y otra vez, ¿quién se vería beneficiado con su eliminación?
Claramente, no sería ni la población ni las arcas fiscales.
Ediciones, revisiones, confusiones y malas lecturas
Las revistas científicas son un tipo bien particular de publicación. Para empezar, están dirigidas a un público especializado en cierto tema o que, al menos, maneja ciertos códigos que no son evidentes para quien sólo suele leer novelas, blogs y diarios electrónicos.
Por ejemplo, un lector o lectora de revistas científicas sabe de antemano que correlación es distinto de causalidad o que hablar de la toxicidad de un compuesto no significa necesariamente que ese compuesto sea tóxico en las dosis a las que habitualmente se expone un ser humano. Una lectora o lector de revistas científicas sabe también que ciertos artículos son más idóneos para ciertas revistas y no para otras, aunque en apariencia los temas que tratan no sean tan distintos.
En el caso específico del artículo de Risher y Tucker, nos llama la atención que haya sido publicado en una revista sobre toxicología ambiental. Considerando la importancia de este tema para la salud pública (así como el nivel de exposición mediática del tema), tenía mucho más sentido que un artículo que hable sobre etilmercurio y vacunas apareciera en un revista sobre, precisamente, salud pública. Lo ideal es que una revisión bibliográfica tan extensa como esta fuese revisada por una editora o editor especializado en salud pública o epidemiología. En esta situación concreta, el editor de la revista de toxicología ambiental podría haber recomendado a los autores del artículo que lo presentaran a una revista más a tono con el tema.
Esto nos lleva a otro punto: no podemos ser tan ingenuos como para creer que el proceso de revisión por pares es infalible. Quienes revisan un artículo son humanos y pueden juzgar erróneamente la calidad de un trabajo, ya sea de manera intencional o no. Afortunadamente, existe un proceso de arreglar-cagazos: la retractación de artículos permite a la revista retirar un artículo de publicación si juzga que sus contenidos no son dignos de haber sido publicados (como ha ocurrido con un nuevo estudio que sugería que las vacunas aumentan el riesgo de autismo).
Volviendo a nuestro tema, insistimos en que el artículo de Risher y Tucker no sugiere directamente que el etilmercurio es igual de tóxico que el metilmercurio (como se ha leído erróneamente en muchos medios por internet). Por esto, no resulta raro que el artículo haya sido aprobado tras la revisión por pares. Sin embargo, como el prefacio especifica que su objetivo es revisar la toxicidad de ambos compuestos, a ojos de alguien no habituado a leer este tipo de artículos resulta muy fácil malinterpretar las conclusiones.
Por desgracia, la desinformación malintencionada utiliza cada vez más los mismos canales de la ciencia, o medios que aparentan una seriedad de la que carecen. Esta situación se vuelve más crítica en el escenario actual, en el que hay escasez de revisores para la gran cantidad de artículos que se escriben (no olvidemos que las científicas y científicos sufren una presión enorme por parte de sus instituciones académicas para publicar lo más posible). Esto ha llevado a situaciones lamentables, como artículos aceptados sin haber tenido una revisión final (como ocurrió con uno publicado en PLoS ONE y posteriormente retractado) o a la retractación de artículos con muchos años de retraso (como ocurrió con la gran vergüenza de The Lancet: el tristemente célebre artículo de Wakefield, retractado casi 12 años después de su publicación pese a que años antes 10 de sus 13 coautores rechazaron las conclusiones de su propio artículo). Los ejemplos suman y siguen.
Pero, pese a los cuestionamientos que podamos tener sobre él, el artículo de Risher y Tucker es un artículo científico. Y resulta curioso que los grupos antivacuna y en general grupos escépticos de la vacunación, que suelen rechazar toda evidencia publicada por los canales oficiales de la ciencia, acepten tan alegremente este artículo. Más curioso aún cuando las referencias citadas por Risher y Tucker afirman exactamente lo contrario a lo que postulan sitios antivacuna como los promovidos por Robert F. Kennedy. Entonces, ¿por qué aceptar sólo los artículos que (aparentemente) reafirman su punto de vista?
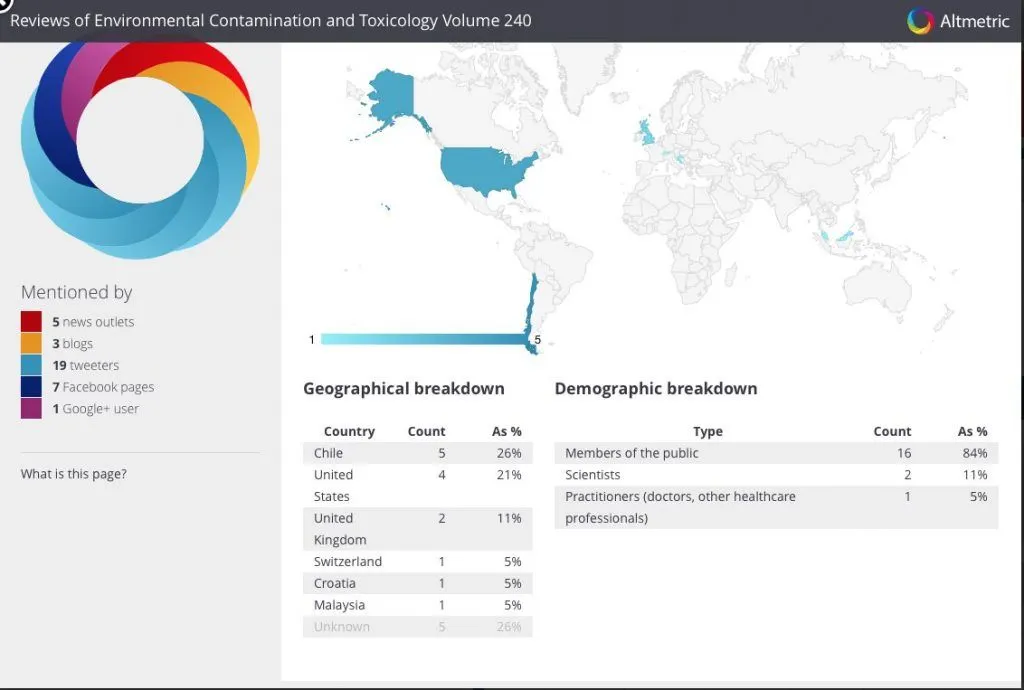
Este artículo, a más de un año de su publicación, ha sido mencionado y citado muy pocas veces. La mayoría sólo los últimos meses. El 26% de estas ha sido acá, en Chile. Luego, un 21% en EE. UU., en sitios antivacuna o promovidos por el conocido activista ambiental y escéptico de las vacunas Robert F. Kennedy.
He aquí el meollo del asunto: la credibilidad de una afirmación no está dada por las credenciales, los pergaminos ni por la fama (ni las nuestras ni las de nadie). Si así fuese, aún diríamos que la Tierra es el centro del universo, tal como lo afirmaba Ptolomeo. Incluso investigadores galardonados con el Nobel han debido reconocer sus errores y retractar artículos.
La credibilidad de una afirmación se encuentra en la solidez de sus argumentos, en el rigor con la que se ha construido, así como en la calidad y la cantidad de sus revisiones. Es este método lo que ha permitido a la ciencia, por ejemplo, mejorar en forma sustantiva nuestras expectativas de vida. Y esto pese a la tendencia del ser humano de defender sus prejuicios aun cuando tenemos toda la evidencia en contra.
Si hay algo realmente importante que ha aprendido el ser humano a través del método científico es que no existen las verdades irrefutables. Lo que existen son hechos comprobados con evidencia. Cuando las evidencias apuntan en otra dirección, lo que debe hacer la ciencia es cuestionar lo que ha afirmado por mucho tiempo y buscar nuevas explicaciones a los fenómenos observados. Y, en este proceso, resulta fundamental la revisión crítica. Incluso la revisión crítica de eminencias o de teorías e investigaciones que han sido revisadas una y otra vez por pares.
La invitación, entonces, es a no quedarse con el titular porque nos gustó lo que dice. ¿El contenido del artículo afirma lo mismo que su título? ¿Cuáles son sus fuentes? ¿Están de acuerdo estas fuentes con lo afirmado por el artículo que está leyendo? ¿Está correctamente aplicada la metodología? ¿Hay alguien que haya criticado el artículo y, si es así, cuál es la naturaleza de sus críticas?
Por todo lo anterior, podemos reafirmar sin un dejo de duda lo que ya sabíamos: las dosis de timerosal que se administran en las vacunas a lo largo de la vida de un ser humano son inocuas.
Así es que respiramos con tranquilidad: nuestro medio mantendrá su nombre con orgullo.
Anexo para gente con TOC
Como no podemos hacer menos que seguir nuestros propios consejos, a continuación le presentamos una revisión de las referencias aparecidas en la conclusión del artículo de Risher y Tucker. En el cuadro, separamos las referencias que hablan del timerosal (o del etilmercurio) de las que no, además de especificar lo que realmente dicen al respecto.
Como dato, de los 41 artículos citados, 12 de ellos mencionan al timerosal, 28 de ellos no lo hacen y a uno no tuvimos acceso. O sea, menos del 32% de los artículos citados siquiera mencionan al timerosal (y los que lo hacen no siempre dicen lo que los autores de la recopilación creen que dicen). Más grave aún, muchas de sus conclusiones generalizadas para ambos compuestos están sólo respaldadas para el metilmercurio o para el mercurio en general.
Show All
Referencias
1.
Immunization Safety Review: Vaccines and Autism [Internet]. Washington, D.C.: National Academies Press; 2004 [citado 18 de mayo de 2017]. Disponible en: http://www.nap.edu/catalog/10997
2.
On the wrong side of history. Nature Microbiology. 28 de marzo de 2017;2(4):17046. Disponible en: https://www.nature.com/articles/nmicrobiol201746
3.
Risher JF, Tucker P. Alkyl Mercury-Induced Toxicity: Multiple Mechanisms of Action. En: de Voogt P, editor. Reviews of Environmental Contamination and Toxicology Volume 240 [Internet]. Cham: Springer International Publishing; 2016 [citado 18 de mayo de 2017]. p. 105–49. Disponible en: http://link.springer.com/10.1007/398_2016_1
4.
World Health Organization. Thiomersal in vaccines [Internet]. Global Vaccine Safety. 2011. Disponible en: http://www.who.int/vaccine_safety/committee/topics/thiomersal/questions/en/
5.
World Health Organization. Tiomerosal. Preguntas y Respuestas [Internet]. Inmunización, Vacunas y Productos Biológicos. 2011. Disponible en: http://www.who.int/immunization/newsroom/thiomersal_questions_and_answers/es/
6.
World Health Organization. Posición del Comité Consultivo Mundial sobre Seguridad de las Vacunas sobre la preocupación suscitada por un artículo acerca de la seguridad de las vacunas que contienen tiomersal [Internet]. Iniciativa global sobre la seguridad de las vacunas. 2003. Disponible en: http://www.who.int/vaccine_safety/committee/topics/thiomersal/statement/es/
7.
Peter Hotez. The “Why Vaccines Don’t Cause Autism” Papers [Internet]. PLoS Blogs. 2017. Disponible en: http://blogs.plos.org/speakingofmedicine/2017/01/20/the-why-vaccines-dont-cause-autism-papers/
8.
United states Environmental Protection Agency. Thimerosal in Vaccines [Internet]. Disponible en: https://www.epa.gov/mercury/thimerosal-vaccines
9.
Muñoz M A, Abarca V K, Jiménez de la J J, Luchslnger F V, O’Ryan G M, Ripoll M E, et al. Seguridad de las vacunas que contienen timerosal: Declaración del Comité Consultivo de Inmunizaciones (CCI) de la Sociedad Chilena de Infectología. Revista chilena de infectología [Internet]. octubre de 2007 [citado 18 de mayo de 2017];24(5). Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182007000500004&lng=en&nrm=iso&tlng=en
10.
Driscoll CT, Mason RP, Chan HM, Jacob DJ, Pirrone N. Mercury as a Global Pollutant: Sources, Pathways, and Effects. Environmental Science & Technology. 21 de mayo de 2013;47(10):4967–83. Disponible en: http://pubs.acs.org/doi/abs/10.1021/es305071v
11.
World Health Organization. El mercurio y la salud [Internet]. Centro de Prensa. 2017. Disponible en: http://www.who.int/mediacentre/factsheets/fs361/es/
12.
«Oficio de S.E. el Presidente de la República. (BOLETÍN N° 7036‐11)» en LEGISLATURA 361ª, Sesión 121ª, en martes 4 de marzo de 2014 de la Cámara de Diputados de Chile, pp. 153-156. https://www.camara.cl/pdf.aspx?prmID=10412%20&prmTIPO=TEXTOSESION