Disclosure: Ningún miembro del equipo de Etilmercurio tiene conflictos de interés en el tema. Estamos todos poniendo a disposición nuestro tiempo con el único fin de difundir ciencia. Nuestro único conflicto es con las tasas de interés. Particularmente con las hipotecarias. Pero eso es otra cosa.
En vista del éxito de nuestro primer P.A.I.P.E. sobre la vacuna contra el VPH, hemos decidido hacer una segunda parte, revisando más literatura, algunos artículos nuevos muy bien hechos, fuentes confiables, etc. Este tema sigue siendo de extrema importancia y pensamos que se le ha dado igual validez a dos posiciones contrapuestas: una validada por evidencias científicas y otra por prejuicios y experiencias personales, las cuales no deben ser usadas para delinear políticas públicas en temas de salud. Como equipo, podemos aportar un poco a liberar los artículos científicos que se encuentran «encerrados» en revistas especializadas, para que estén disponible para usted y pueda tener una opinión informada sobre el tema. Esto es algo que nos compete a todos.
1. ¡La vacuna no cubre los serotipos que nos afectan!
¡FALSO!
La vacuna tetravalente cubre contra los serotipos 6, 11, 16 y 18. Estas 4 cepas son responsables de aproximadamente el 70% de los cánceres de cuello uterino y el 90% de las verrugas genitales (1).
Además, la vacuna ha demostrado una y otra y otra y otra vez ser muy efectiva:
•
«Basándonos en la cobertura de la vacuna, las reducciones (de casos nuevos de neoplasia cervical intraepitelial) fueron mayores que las anticipadas: esto apoya la protección cruzada vacunal, la eficacia de menos de 3 dosis y la contribución a la inmunidad de rebaño (2)».
•
«Se han reportado reducciones máximas de ~90% en infecciones por el VPH 6/11/16/18, ~90% de verrugas genitales, ~45% en anomalías citológicas de bajo grado y ~85% en anomalías citológicas de alto grado (3). Esto da cuenta del alto impacto de la vacunación contra el VPH».
•
«En los 6 años desde que se inició la vacunación, se produjo una disminución de 64% en la prevalencia de 4vVPH en las mujeres de 14-19 años y un 34% de disminución en las de 20-24 años. Estos hallazgos amplían las observaciones previas sobre el impacto poblacional en EE. UU. y muestran la primera evidencia nacional de impacto en mujeres a esas edades (4)».
•
«El estudio entrega evidencia robusta de los beneficios tempranos de la vacunación contra el VPH en las niñas de 14-17 años. Además, entrega justificaciones adicionales para no retrasar la vacunación (5)».
•
«La eficacia de la vacuna contra la infección persistente a los 12 meses con VPH-16/18 fue de 89.99% (84.0-94.0), y contra VPH-31/33/45/51 fue de 49.0% (34.7-60.3%). En conclusión, vacunar adolescentes antes del inicio de su vida sexual tiene un impacto sustancial en la incidencia general de anomalías cervicales de alto grado; asimismo, la vacunación rezagada a los 18 años de edad es probablemente efectiva (6)».
•
«Además, se observó una reducción significativa en los diagnósticos de neoplasia cervical intraepitelial (CIN 1; RR 0.71, 95% IC 0.58-0.87; P=0.0008), CIN 2 (RR 0.5, 95% IC 0.4-0.63; P<0.0001) y CIN 3 (RR 0.45, 95% IC 0.35-0.58; P<0.0001) en mujeres que recibieron tres dosis de la vacuna comparadas con mujeres no vacunadas (7)».
•
«El éxito del programa en la comunidad se ve resaltado por la gran disminución en el manejo de verrugas genitales de mujeres en edad de recibir la vacuna (8)».
•
«La prevalencia de infección por VPH 16/18 en una encuesta post inmunización fue de 6.5% entre jóvenes de 16-18 años, comparada con 19.1% en un grupo similar realizado previo a la introducción de la vacuna (9)».
•
«En las adolescentes de 14 a 19 años, la prevalencia de VPH-6, -11, -16 o -18, disminuyó desde 11.5% (95% IC 9.2-14.4) en 2003-2006 a 5.1% (95% IC 3.8-6.6) en 2007-2010, un descenso de 56% (95% IC 38-69) (10)».
•
«Los datos demuestran que la vacuna tetravalente VPH-6/11/16/18 fue altamente efectiva en prevenir lesiones cervicales de alto grado asociadas con VPH-16 y VPH-18. La inmunización ampliada a niñas y adolescentes podría resultar en una disminución sustancial de enfermedades relacionadas, incluyendo cáncer cervical (11)».
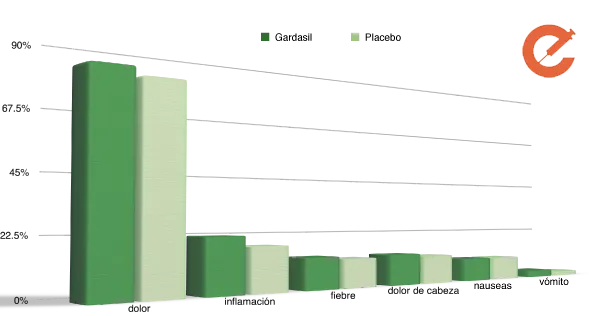
Porcentaje de casos
Bonus: Los efectos secundarios reportados, no son distintos a los de otros tratamientos médicos. Se han comparado efectos secundarios con placebos mostrando resultados similares (Gráfico basado en la referencia 11).
2. La vacuna no previene el cáncer… ¡Sólo previene el virus papiloma!
¡Duh! Reformulemos...
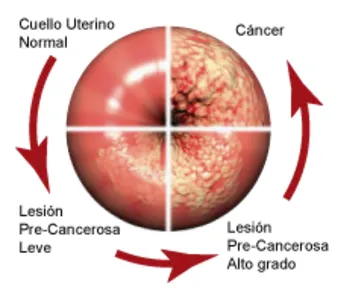
¿Cómo hace el VPH de alto riesgo para causar cáncer?
El VPH infecta las células epiteliales. Estas células, que están organizadas en capas, cubren las superficies interior y exterior del cuerpo, incluyendo la piel, la garganta, el tracto genital y el ano.
Una vez que el VPH ingresa a una célula epitelial, inicia la expresión de sus genes. Dos de las proteínas generadas por el VPH de alto riesgo (E6 y E7) interfieren con las funciones celulares que normalmente previenen el crecimiento excesivo, lo que favorece un crecimiento descontrolado de la célula y no permite que la célula muera. Muchas veces, estas células infectadas son reconocidas por el sistema inmune y eliminadas. A veces, sin embargo, estas células infectadas no son destruidas, lo que resulta en una infección persistente. A medida que estas células continúan creciendo, pueden desarrollar mutaciones que promueven mayor crecimiento anormal, llevando a la formación de un área de células precancerosas y, finalmente, un tumor canceroso. Puede tomar entre 10 a 30 años desde la infección inicial con VPH hasta la formación de un tumor (12).
3. ¡La vacuna no dura nada! En unos años, ¡PAF!, se «diluye». ¿Para qué voy a vacunar a mi hija si es joven y no va a tener relaciones sexuales mientras la vacuna mantiene su efecto?
FALSO
La vacuna HPV entrega protección a largo plazo, al menos por 8-10 años, de acuerdo a datos de ensayos clínicos e investigaciones en desarrollo. Esto no significa que la protección de la vacuna se vaya después de 10 años. No existe evidencia alguna de la pérdida de protección en el tiempo (13).
La vacuna HPV tetravalente administrada a los adolescentes demuestra protección clínica efectiva y títulos de anticuerpos sostenidos por 8 años. Estos datos, junto con extensa literatura de seguridad post aprobación, ayuda a reforzar las recomendaciones nacionales para la vacunación contra el VPH en preadolescentes y adolescentes (14).
4. ¡Necesitamos más dosis! O sea, ¡menos dosis! O sea, ¿cuántas dosis?
Los esquemas de vacunación aprobadas son 2 o 3 dosis, dependiendo de los países (15):
Estos datos sugieren una evaluación directa de la eficacia de una dosis de la vacuna VPH-16/18 (16).
Los niveles de anticuerpos posteriores a una dosis se mantuvieron estables desde el mes 6 al mes 48. Los resultados sugieren la posibilidad de que una dosis de la vacuna contra el VPH induzca protección a largo plazo (17).
5. ¡La vacuna deberían ponérsela también a los niños!
En esto estamos de acuerdo.
En Chile, la Sociedad de Pediatría ha hecho un llamado para incorporarlos como público objetivo.
Ahora, este hecho no constituye de ninguna forma un argumento para no vacunar a las niñas: mientras más personas se vacunen, mejor.
6. ¡La vacuna es muy cara! El costo/beneficio no nos favorece. ¿Y si esperamos a ver si nos da cáncer cervicouterino mejor? Son sólo 40.000 mujeres en 30 años (?)
Luego de notar que hay suficiente evidencia para demostrar la efectividad y seguridad de la vacuna, hemos escuchado algunos argumentos que tienen que ver con razón costo a beneficio de la aplicación de la misma. Es deplorable que una política pública destinada a prevenir un cáncer que provocó en el año 2012 la muerte de 584 mujeres y cerca de 1.279 casos nuevos cada año (18), sea visto desde esa perspectiva. Y claro, el beneficio evidente para el país de eliminar inequidades en la salud de la población no es considerado en ese simplón argumento.
Y por cierto, un estudio hecho en Chile concluyó que la estrategia de vacunación contra el VPH es MUY costo-efectiva (19).
7. Mi ginecólogo/pediatra/médico de cabecera/lo que sea se opone a la vacuna. ¿Por qué debería hacerle caso a ustedes?
¿No ha pensado en pedir una segunda opinión? Como hemos señalado en las respuestas anteriores, la evidencia señala que la vacuna es segura y efectiva. Lo que opine un médico, o un grupo de ellos, no cambia los hechos. En Etilmercurio nos importa la evidencia. La Sociedad Chilena de Obstetricia y Ginecología (Sochog), las Sociedades de Ginecología y Obstetricia Infantil y de la Adolescencia (Sogia), la Sociedad Chilena de Pediatría (Sochipe), la Sociedad Chilena de Infectología (Sochinf) y el Colegio Médico (Nacional y Regional Valdivia) concuerdan con nuestra interpretación de la evidencia. También lo hace la OMS/OPS.
8.- ¡Pero en los colegios particulares puedes oponerte a que vacunen a tu hija!
¡FALSO!
Fuente: Ministerio de Salud.
9. Bueno, pero la diputada Girardi sigue teniendo razón.
No. Nunca. Jamás. En ninguna parte. La diputada Girardi es consistentemente falaz en sus declaraciones y en su manera de argumentar. Ha reconocido que obtiene información de Yahoo Answers (un sitio donde cualquiera puede escribir respuestas) y muestra un manejo muy pobre en términos técnicos. Girardi dice que «no es antivacunas», pero plantea como un problema que la vacuna sea obligatoria. A pesar de esto, la diputada Girardi no es inconsciente de los beneficios de las vacunas, ya que admitió haber vacunado a sus hijos. La diputada Girardi se aprovecha de una inquietud en la población, exacerbada por personas y grupos antivacunas, para ganar notoriedad de manera irresponsable. Merecemos mejores políticos.
Referencias
Nota: Hay referencias que son de acceso abierto, pero para las que no, puede usar Sci-hub. Acá le mostramos cómo.
La idea es que pueda ver por usted mismo cada fuente utilizada y no sólo una cita sacada de contexto, como ocurre regularmente en algunos sitios.
1.
Ministerio de Salud. Chile. Preguntas frecuentes sobre Vacunación contra el Virus del Papiloma Humano [Internet]. Vacunación contra el Virus del Papiloma Humano. 2015 [citado 23 de septiembre de 2016]. Disponible en: http://www.cdc.gov/hpv/parents/questions-answers.html
2.
Benard VB, Castle PE, Jenison SA, Hunt WC, Kim JJ, Cuzick J, et al. Population-Based Incidence Rates of Cervical Intraepithelial Neoplasia in the Human Papillomavirus Vaccine Era. JAMA Oncol [Internet]. 29 de septiembre de 2016 [citado 5 de octubre de 2016]; Disponible en: http://oncology.jamanetwork.com/article.aspx?doi=10.1001/jamaoncol.2016.3609
3.
Garland SM, Kjaer SK, Muñoz N, Block SL, Brown DR, DiNubile MJ, et al. Impact and Effectiveness of the Quadrivalent Human Papillomavirus Vaccine: A Systematic Review of 10 Years of Real-world Experience. Clin Infect Dis. 15 de agosto de 2016;63(4):519–27.
4.
Markowitz LE, Liu G, Hariri S, Steinau M, Dunne EF, Unger ER. Prevalence of HPV After Introduction of the Vaccination Program in the United States. PEDIATRICS. 1 de marzo de 2016;137(3):e20151968–e20151968.
5.
Smith LM, Strumpf EC, Kaufman JS, Lofters A, Schwandt M, Levesque LE. The Early Benefits of Human Papillomavirus Vaccination on Cervical Dysplasia and Anogenital Warts. PEDIATRICS. 1 de mayo de 2015;135(5):e1131–40.
6.
Apter D, Wheeler CM, Paavonen J, Castellsagué X, Garland SM, Skinner SR, et al. Efficacy of Human Papillomavirus 16 and 18 (HPV-16/18) AS04-Adjuvanted Vaccine against Cervical Infection and Precancer in Young Women: Final Event-Driven Analysis of the Randomized, Double-Blind PATRICIA Trial. Plotkin SA, editor. Clinical and Vaccine Immunology. abril de 2015;22(4):361–73.
7.
Pollock KGJ, Kavanagh K, Potts A, Love J, Cuschieri K, Cubie H, et al. Reduction of low- and high-grade cervical abnormalities associated with high uptake of the HPV bivalent vaccine in Scotland. Br J Cancer. 28 de octubre de 2014;111(9):1824–30.
8.
Harrison C, Britt H, Garland S, Conway L, Stein A, Pirotta M, et al. Decreased Management of Genital Warts in Young Women in Australian General Practice Post Introduction of National HPV Vaccination Program: Results from a Nationally Representative Cross-Sectional General Practice Study. Burk RD, editor. PLoS ONE. 2 de septiembre de 2014;9(9):e105967.
9.
Mesher D, Soldan K, Howell-Jones R, Panwar K, Manyenga P, Jit M, et al. Reduction in HPV 16/18 prevalence in sexually active young women following the introduction of HPV immunisation in England. Vaccine. diciembre de 2013;32(1):26–32.
10.
Markowitz LE, Hariri S, Lin C, Dunne EF, Steinau M, McQuillan G, et al. Reduction in Human Papillomavirus (HPV) Prevalence Among Young Women Following HPV Vaccine Introduction in the United States, National Health and Nutrition Examination Surveys, 2003-2010. J Infect Dis. 1 de agosto de 2013;208(3):385–93.
11.
The FUTURE II Study Group. Quadrivalent Vaccine against Human Papillomavirus to Prevent High-Grade Cervical Lesions. New England Journal of Medicine. 10 de mayo de 2007;356(19):1915–27.
12.
13.
Center for Disease Control and Prevention. Questions and Answers [Internet]. Human Papillomavirus. 2015. Disponible acá.
14.
Ferris D, Samakoses R, Block SL, Lazcano-Ponce E, Restrepo JA, Reisinger KS, et al. Long-term Study of a Quadrivalent Human Papillomavirus Vaccine. PEDIATRICS. 1 de septiembre de 2014;134(3):e657–65.
15.
Asociación Española de Pediatría. Capítulo 42: Virus del Papiloma Humano [Internet]. Manual de Vacunas en Línea de la AEP. Disponible acá.
16.
Kreimer AR, Struyf F, Del Rosario-Raymundo MR, Hildesheim A, Skinner SR, Wacholder S, et al. Efficacy of fewer than three doses of an HPV-16/18 AS04-adjuvanted vaccine: combined analysis of data from the Costa Rica Vaccine and PATRICIA trials. The Lancet Oncology. julio de 2015;16(7):775–86.
17.
Safaeian M, Porras C, Pan Y, Kreimer A, Schiller JT, Gonzalez P, et al. Durable Antibody Responses Following One Dose of the Bivalent Human Papillomavirus L1 Virus-Like Particle Vaccine in the Costa Rica Vaccine Trial. Cancer Prev Res (Phila Pa). 1 de noviembre de 2013;6(11):1242–50.
18.
Subsecretaría de Salud Pública Ministerio de Salud. Guías Clínicas AUGE Cáncer Cérvico Uterino [Internet]. 2015. Disponible acá.
19.
Sergio Poblete Vargas. Actualización de Resultados de Costo-Efectividad del Estudio “Sistematización de la Información sobre Cáncer Cérvico Uterino en Chile: Revisión y Análisis de Estudios de Costo Efectividad de la Vacuna contra VPH” [Internet]. 2013. Disponible acá.