El año (2015), la prestigiosa revista Science escogió a una técnica llamada CRISPR como el avance científico del año. En el 2016, el prestigioso blog de difusión de ciencia Etilmercurio (?) hace lo propio y le dedica uno de sus entretenidos post a esta revolucionaria técnica.
Quizás usted leyó hace unos días una noticia esperanzadora: un grupo científico en China utilizó por primera vez la técnica CRISPR-Cas9 (que utiliza la edición genética) en un ser humano para atacar un cáncer de pulmón de células no pequeñas metastásico (un nombre técnico para describir un cáncer agresivo; de hecho, pasó un hincha de barra brava con un machete en la mano, y le gritó a ese tipo de cáncer que era muy agresivo). Los resultados preliminares aparecieron publicados en la revista Nature (1) y corresponden a un protocolo de Ensayo Clínico en Fase I. O sea, cuando están probando qué tan seguro es el tratamiento, cuáles son los potenciales efectos secundarios (y qué tan severos son), qué dosis son las adecuadas... Hay que andarse con cuidado, ya que podrían estar eliminando el cáncer y de paso convirtiendo en gelatina todos los huesos del sujeto de pruebas. Es por eso que para esta fase se suele trabajar con los casos más extremos, en los que hay pocas esperanzas de recuperación.
El entusiasmo que genera esta noticia es comprensible. Después de todo, desarrollar un tratamiento contra el cáncer es algo así como la Piedra Filosofal de la medicina (y no hay ningún Harry Potter hablando en falso latín que nos pueda ayudar). Además, como este ensayo se está realizando en China, ya se está hablando de una especie de «Sputnik 2.0», o un duelo biomédico entre China y Estados Unidos. Lo bueno de esta rivalidad es que podría ser una ganancia para todo el mundo: el espíritu competitivo siempre ha sido un incentivo para la investigación (recordemos, por ejemplo, que Charles Darwin se decidió a publicar El origen de las especies cuando descubrió que Alfred Russel Wallace estaba llegando a sus mismas conclusiones).
Pero si usted leyó la noticia, quizás se quedó marcando ocupado: ¿qué demonios es eso de CRISPR/Cas9? ¿Cuándo la inventaron? ¿Es Made in China, como mi ropa y mi computador?
Trataremos de que esto no le parezca chino: el CRISPR/Cas9 es una herramienta molecular que permite realizar ediciones en el genoma humano. Algo así como un procesador de textos genético, con función «copy-paste» incluida (sí, esa función que usted usaba para «escribir» sus trabajos del colegio y la universidad). CRISPR es la sigla de «Clustered Regularly Interspaced Short Palindromic Repeats», algo así como «repeticiones palindrómicas cortas interespaciadas y agrupadas regularmente»... Ah, y se nos olvidaba agregar la proteína que participa en este ensayo: la Cas9.
Listo.
¿Confundidos? ¡Maravilloso! ...OK, de acuerdo: decir qué significa una sigla no es una explicación. Seamos más claros.
Aplicando tijeras al genoma
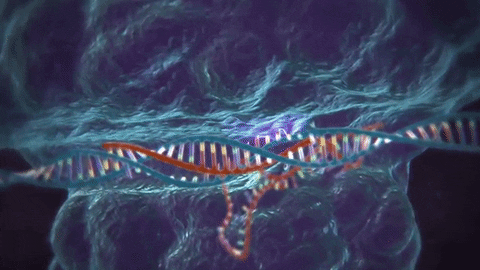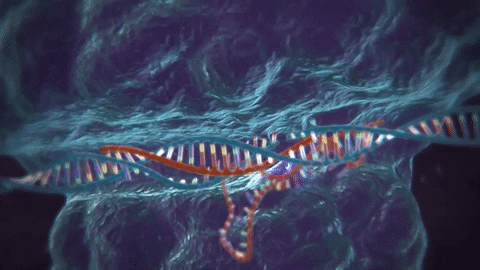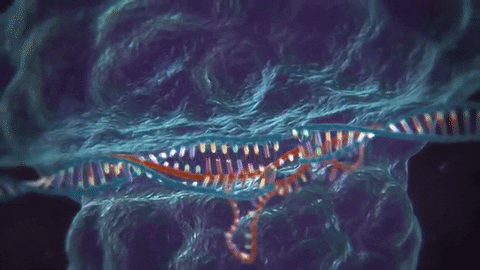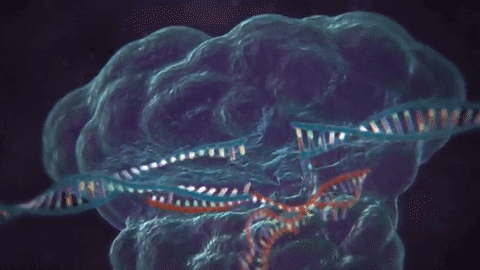
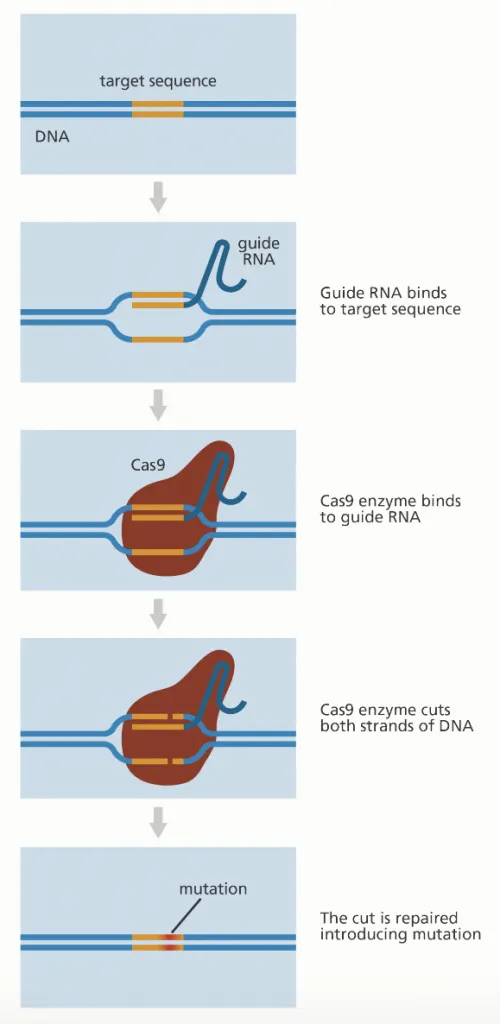
El CRISPR/Cas9 es una de las varias técnicas de edición de ADN que existen: su ventaja es que resulta más barata y más precisa que otras utilizadas previamente. La técnica consiste en utilizar dos moléculas complejas para introducir cambios (o sea, mutaciones artificiales) en el genoma. Una es la proteína Cas9, que actúa como una especie de «tijera» genética, cortando el ADN en zonas específicas; la segunda es un trozo de ARN llamado ARN guía (gRNA en inglés), que es una pieza de ARN prediseñada que, tal como dice su nombre, guía a la proteína Cas9 para que aplique el corte en el lugar deseado (1).
Luego de la actuación de la «tijera proteica», la célula reconoce que está dañada y trata de repararse. En esta etapa, los científicos utilizan la maquinaria de reparación del ADN para introducir modificaciones en uno o más genes.
O sea, ¿con esta técnica puedo cambiar mis genes para tener los ojos azules?
A ver: la edición genética puede, teóricamente, hacer maravillas, pero no es una varita mágica. Si se utiliza para modificar el código genético de embriones humanos, podría diseñarse el color del pelo y de los ojos, además de muchas otras variables genéticas. Pero en humanos ya creciditos, las aplicaciones son más restrictivas... Aunque no menos sorprendentes. Por ejemplo, el investigador español José Luis García Pérez cree que podría utilizarse para tratar enfermedades monogénicas, como la fibrosis quística o la degeneración de la mácula en el ojo (2). Ya se han realizado algunos ensayos clínicos con otras técnicas que han dado resultados promisorios en pacientes con VIH y leucemia (3,4). Por lo tanto, no sería raro que pronto se aplicara la técnica CRISPR-Cas9 para continuar este tipo de investigaciones (sobre todo porque trabajar con el CRISPR-Cas9 cuesta menos de un 1% de lo que cuestan otras técnicas), o para tratar la adicción al chocolate, algo así como un choco-CRISPR. Ese chiste no sólo es malo, sino que es irreal: ¿Quién querría quitarse el gusto por el chocolate?
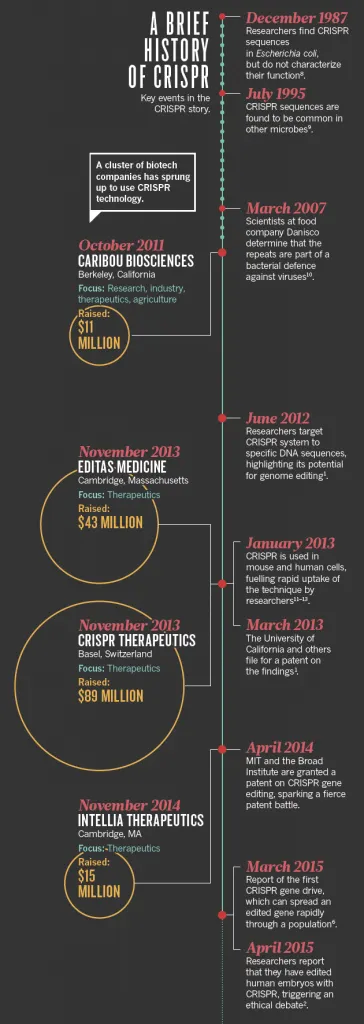
Aunque parezca novedosa, la técnica CRISPR lleva bastantes años siendo utilizada (5), como podemos ver en la siguiente línea de tiempo.
Extraído de Nature: CRISPR, the disruptor
El asunto es que era una técnica que se usaba principalmente para modificar bacterias, hasta que llegaron algunos investigadores visionarios como Emmanuelle Charpentier, Feng Zhang y Jennifer Doudna, que descubrieron cómo funcionaba el mecanismo y decidieron aplicarlo en mamíferos (2). ¿Alguien dijo Premio Nobel por ahí?
Ahora, precisamente por preguntas como la que usted se hace, estos avances no han estado exentos de polémica (6). Después de todo, dedicarse a editar los genes de embriones es el punto de partida de muchas historias de ciencia ficción distópica.
Pero volvamos a lo nuestro: ¿qué fue lo que hicieron en China?
El equipo de investigación extrajo células inmunitarias de la sangre de un paciente y luego utilizó la técnica CRISPR-Cas9 para «desconectar» los códigos genéticos que codifican la proteína PD-1, que también se conoce como la «proteína de la muerte programada» (Programmed Death-1). La PD-1 es una de las proteínas que le impide a nuestro sistema inmune eliminar células tumorales malignas (algo así como el código ético de Batman, que le impide matar incluso a psicópatas como el Joker). Por lo tanto, bloquear esta proteína es un objetivo muy deseable por su potencial terapéutico en procesos oncológicos (7).
Por supuesto, la PD-1 cumple una función importante en el sistema inmune: ayuda a mantener un balance de células T, lo que resulta determinante en el control de enfermedades infecciosas, del cáncer y la mantención del equilibrio en la dicotomía del sistema inmune (El balance de la inmunidad es importante para mantener bajo control a las infecciones, el cáncer y desarrollar tolerancia a los propios antígenos, lo que evita el daño a los tejidos por una respuesta exagerada del sistema inmune). Pero ojo, lo que están tratando de hacer es salvar la vida de personas con un cáncer muy agresivo.
El equipo de oncólogos de Lu You, de la Universidad de Sichuan, cultivó las células editadas, logró que se multiplicaran y luego las inyectaron de vuelta en el paciente. La teoría dice que, sin el PD-1, las células editadas dejarán de sentir remordimientos y atacarán el cáncer hasta derrotarlo.
Como esta investigación corresponde a un ensayo en Fase I, buscará tratar a 10 personas con la técnica, quienes recibirán 2, 3 o 4 inyecciones para probar potenciales efectos adversos, diferentes dosis y, por supuesto, analizar si los pacientes se ven beneficiados con el tratamiento de linfocitos T modificados genéticamente.
La comida es más rica con CRISPR
Además de sus obvios usos en medicina, la técnica también ha sido utilizada con éxito en agricultura y ganadería. Como es más simple, más económica y más efectiva que otras técnicas, con la CRISPR-Cas9 se han desarrollado pequeños cerdos, trigo y arroz resistentes a diversas enfermedades y naranjas enriquecidas con mayor cantidad de vitaminas.
La técnica también ha permitido generar mosquitos que frenen enfermedades vectoriales (como la malaria y el zika), entre otras aplicaciones (6). Además, el 30 de noviembre de 2016 se anunció que CRISPR-Cas9 había sido utilizada con éxito para corregir la mutación genética que produce la hemofilia B en ratones recién nacidos y adultos (10) (una noticia aplaudida por la realeza europea, pero no con mucho entusiasmo para que no se les produzcan heridas en las manos).
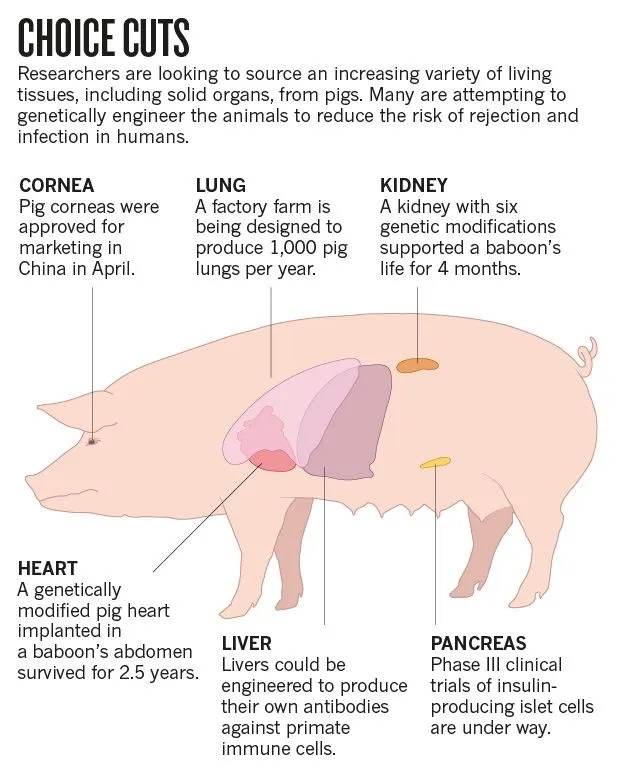
Otra gran ventaja proviene desde los xenotransplantes (no, no son los transplantes que hace Xena, la guerrera; ella se dedica más a extirpar órganos que a reponerlos), que son transplantes de órganos y tejidos desde animales donantes a humanos. La técnica permite editar genes en los cerdos que producen el rechazo inmunológico o infección en los receptores de forma mucho más rápida y segura que con otras técnicas.
De hecho, en octubre de 2016, un equipo en EE. UU. anunció que había logrado editar el genoma de un cerdo en 62 lugares de una vez (8). Se espera que en un futuro próximo se desarrollarán ensayos clínicos en seres humanos con órganos para xenotransplantes editados genéticamente. Uno de los más promisorios es el transplante de islotes pancreáticos de cerdos a pacientes diabéticos (9).
¿A quién debemos agradecer esta técnica maravillosa?
Curiosamente, la técnica CRISPR-Cas9 no fue desarrollada por científicos dedicados a investigar el cáncer, ni fue pagada con dineros de investigación sobre transplantes de órganos, y ni siquiera por compañías como Monsanto que quieren desarrollar supertomates mutantes con colmillos y patas de araña para destruir la humanidad y los completos (?).
No, la técnica CRISPR-Cas9 fue desarrollada por un grupo de investigación en ciencias básicas, que estaba experimentando en edición genética de bacterias. Fue sólo hace unos años que a algunos académicos se les ocurrió que podría utilizarse en mamíferos.
¿Qué significa esto? Que la ciencia está guiada por la curiosidad y la creatividad humana. Resulta muy difícil orientar el trabajo de la ciencia («les vamos a dar todo este dinero para que desarrollen una cura contra el cáncer»), porque cada investigador o investigadora puede hacer descubrimientos que otros no han hecho, o hacerse preguntas que no tienen nada que ver con el foco de su investigación y a veces descubrirá algo que tiene una aplicación completamente distinta a lo esperado originalmente (algo así como Röntgen descubriendo los rayos X por casualidad, mientras jugaba con gases y electricidad, o esos «accidentes científicos» que ocurren en los comerciales de maquill... No, esos no).
Los científicos y científicas son como niños curiosos, a quienes les gusta jugar con las cosas, descubrir qué pasa si hacen algo y luego sacan sus conclusiones al respecto. Y, a veces, estos juegos les permiten descubrir o inventar cosas increíbles.
Por esto, no basta que las naciones entreguen presupuesto a las investigaciones más «sexies», como la cura contra el cáncer o el desarrollo de la teleportación. Tanto el Estado como la sociedad civil deben entender que las ciencias básicas, con sus temas aparentemente poco prácticos, a veces nos permiten dar saltos científicos y tecnológicos inesperados. Por eso, no dejemos de financiar las ciencias básicas: quizás una niña con fibrosis quística lo agradezca en el mediano plazo.
Referencias
1.
Cyranoski D. CRISPR gene-editing tested in a person for the first time. Nature [Internet]. 15 de noviembre de 2016 [citado 18 de noviembre de 2016]; Disponible en: http://www.nature.com/doifinder/10.1038/nature.2016.20988
2.
José Luis García Pérez. «China ya ha empezado a modificar genéticamente embriones humanos con la tecnología CRISPR» [Internet]. Jot Down. 2016. Disponible en: http://www.jotdown.es/2016/08/jose-luis-garcia-perez-china-ya-ha-empezado-modificar-geneticamente-embriones-humanos-la-tecnologia-crispr/
3.
Reardon S. Gene-editing method tackles HIV in first clinical test. Nature [Internet]. 5 de marzo de 2014 [citado 18 de noviembre de 2016]; Disponible en: http://www.nature.com/doifinder/10.1038/nature.2014.14813
4.
Reardon S. Leukaemia success heralds wave of gene-editing therapies. Nature. 5 de noviembre de 2015;527(7577):146–7.
5.
Ledford H. CRISPR, the disruptor. Nature. 3 de junio de 2015;522(7554):20–4.
6.
Cyranoski D, Reardon S. Embryo editing sparks epic debate. Nature. 29 de abril de 2015;520(7549):593–5.
7.
McDermott DF, Atkins MB. PD-1 as a potential target in cancer therapy. Cancer Medicine. julio de 2013;n/a – n/a.
8.
Reardon S. Gene-editing record smashed in pigs. Nature [Internet]. 6 de octubre de 2015 [citado 26 de noviembre de 2016]; Disponible en: http://www.nature.com/doifinder/10.1038/nature.2015.18525
9.
Reardon S. New life for pig-to-human transplants. Nature. 10 de noviembre de 2015;527(7577):152–4.
10.
University of Pennsylvania School of Medicine. "CRISPR used for first time to correct clotting in newborn and adult mice." ScienceDaily. ScienceDaily, 30 November 2016. <www.sciencedaily.com/releases/2016/11/161130125611.htm>